标准列表(部分)
《 DB15/T 1236-2017 动物源性饲料中挥发性盐基氮的测定 自动凯氏定氮仪法 》标准简介
- 标准名称:动物源性饲料中挥发性盐基氮的测定 自动凯氏定氮仪法
- 标准号:DB15/T 1236-2017
- 中国标准分类号:B46
- 发布日期:2017-06-20
- 国际标准分类号:65.120
- 实施日期:2017-09-20
- 技术归口:
- 代替标准:
- 主管部门:内蒙古自治区质量技术监督局
- 标准分类:农业饲料
- 内容简介:
地方标准《动物源性饲料中挥发性盐基氮的测定 自动凯氏定氮仪法》,主管部门为内蒙古自治区质量技术监督局。
《 YY 0970-2023 医疗保健产品灭菌 一次性使用动物源性医疗器械的液体化学灭菌剂 医疗器械灭菌过程的特征、开发、确认和常规控制的要求 》标准简介
- 标准名称:医疗保健产品灭菌 一次性使用动物源性医疗器械的液体化学灭菌剂 医疗器械灭菌过程的特征、开发、确认和常规控制的要求
- 标准号:YY 0970-2023
- 中国标准分类号:C47
- 发布日期:2023-03-14
- 国际标准分类号:11.080.01
- 实施日期:2026-05-01
- 技术归口:
- 代替标准:YY 0970-2013
- 主管部门:国家药监局
- 标准分类:医药卫生技术医药消毒和灭菌消毒和灭菌综合卫生和社会工作
- 内容简介:
行业标准《医疗保健产品灭菌 一次性使用动物源性医疗器械的液体化学灭菌剂 医疗器械灭菌过程的特征、开发、确认和常规控制的要求》,主管部门为国家药监局。本文件规定了对全部或部分来源于动物材料的一次性使用医疗器械进行灭菌的液体化学灭菌剂的特征,以及灭菌开发、确认、过程控制和监控的要求。本文件适用于液体化学灭菌过程中细菌和真菌污染的风险控制,与其他微生物相关的风险可使用其他方法进行评估(见注1)。
《 T/XMSSAL 0070-2023 供厦食品 动物源性食品中120种兽药残留的筛查 液相色谱-高分辨质谱法 》标准简介
- 标准名称:供厦食品 动物源性食品中120种兽药残留的筛查 液相色谱-高分辨质谱法
- 标准号:T/XMSSAL 0070-2023
- 中国标准分类号:/M745
- 发布日期:2023-06-20
- 国际标准分类号:71.040.40
- 实施日期:2023-06-20
- 团体名称:厦门市食品安全工作联合会
- 标准分类:化学分析质检技术服务
- 内容简介:
本文件规定了动物源食品中120种兽药(详细信息见附录A)残留的液相色谱-高分辨质谱筛查方法。本文件适用于畜禽肉、水产品、蜂蜜、牛奶、鸡蛋等动物源食品中120种兽药残留的定性筛查测定,其他动物源食品可参照执行。
《 T/CSBM 0031-2023 动物源性心包制瓣叶通用要求 》标准简介
- 标准名称:动物源性心包制瓣叶通用要求
- 标准号:T/CSBM 0031-2023
- 中国标准分类号:/C358
- 发布日期:2023-04-24
- 国际标准分类号:11.040.40
- 实施日期:2023-10-01
- 团体名称:中国生物材料学会
- 标准分类:外科植入物假体和矫形医疗仪器设备及器械制造
- 内容简介:
4要求4.1物理性能4.1.1外观应无污迹、表面平整、颜色均匀,对褶皱、深痕、磨损、颗粒物、组织分层、血管情况及其他缺陷进行合理控制。4.1.2尺寸各项尺寸数值应符合制造商的规定。4.1.3拉伸强度拉伸强度应符合制造商的规定。4.1.4伸长率伸长率应符合制造商的规定。4.1.5弹性模量弹性模量应符合制造商的规定。4.1.6缝线牵拉强度缝线牵拉强度应符合制造商的规定。4.1.7热皱缩温度热皱缩温度应满足制造商的规定。4.1.8组织含水量如适用,宜进行瓣叶含水量的测试,其含水量应满足制造商制定要求。注:此项评估适用于经过干燥处理工艺的瓣叶。4.2化学性能4.2.1酸碱度检验液pH值与同批空白液pH值之差不应超过1.5。4.2.2重金属总量检验液中重金属(以Pb计)的总含量不应超过1μg/mL,其中镉含量不应超过0.1μg/mL。4.2.3溶剂残留瓣叶制造过程中涉及的交联剂及其他化学助剂残留的许可限量,宜按照GB/T16886.17的方法来确立,其含量应满足制造商制定要求。4.3生物学性能4.3.1生物负载应满足《中华人民共和国药典》(2020年版)中微生物限度的要求。4.3.2细菌内毒素应满足《中华人民共和国药典》(2020年版)中细菌内毒素的要求。4.3.3生物学评价应按照GB/T16886.1的原则并结合终产品特性进行生物学评价。4.3.4免疫原性评估根据材料特性制定引起免疫反应物质的定性定量控制要求,按照GB/T16886.20的原则进行评价。4.3.5病毒灭活/去除有效性评估根据材料特性考虑病毒和/或传染性因子风险,按照YY/T0771.1的原则进行评价。4.3.6抗钙化性能瓣叶抗钙化性能应优于未经抗钙化处理材料,或不劣于已上市产品或其他适宜材料的对照样品。4.3.7抗降解性能对于使用新型交联方式或交联剂的瓣叶,制造商可选择已上市产品或其他适宜材料作为对照开展评估,设置平行试验比较供试样与对照的差异,应不劣于对照样品。注:动物源性心包材料交联固定是保证其在体内长期稳定使用的前提,否则容易在体内发生降解,可基于传统戊二醛交联方式的临床安全性结果来对比评估。4.3.8血小板功能制造商可根据材料特性开展评估,选择已上市产品或其他适宜材料作为对照,设置平行试验比较供试样与对照的差异,应不劣于对照样品。注:通过测定产品与血小板相互作用,以评估测定样品对血小板功能的潜在影响。血小板的激活是血栓形成的前期,宜通过多种方式来评价心包材料浸泡在处理后的血液中,会产生的血小板激活情况,宜选用血小板颗粒物质、血小板计数及血小板形态方法来进行评估。4.3.9纤维蛋白原吸附制造商宜根据产品特性开展评估,选择已上市产品或其他适宜材料作为对照,设置平行试验比较供试样与对照的差异,应不劣于对照样品。注:凝血反应中的蛋白凝血酶会催化使可溶性纤维蛋白原转变成血栓的主要成分-不溶性纤维蛋白形成,瓣叶与纤维蛋白原作用研究评估可用于瓣叶改性及处理工艺的优化。5检测方法5.1物理性能5.1.1外观显微镜放大5倍或正常目视观察。5.1.2尺寸使用通用量具测量。5.1.3拉伸强度应按照附录A中的方法进行。5.1.4伸长率应按照附录A中的方法进行。5.1.5弹性模量应按照附录B中的方法进行。5.1.6缝线牵拉强度应按照YY/T0500-2021中附录A.5.8的方法进行。5.1.7热皱缩温度应按照QB/T2713或附录C中的方法进行。5.1.8组织含水量应按照《中华人民共和国药典》(2020年版)中水分测定法中的方法进行。5.2化学性能5.2.1检验液制备按照GB/T16886.12的规定在(37±1)℃下浸提(72±2)h制备检验液,制备的检验液用于检测酸碱度及重金属总量。按照GB/T16886.18—2022中第5章要求进行浸提实验设计来制备浸提液,用于检测溶剂残留。5.2.2酸碱度按照GB/T14233.1-2022中5.4.1的方法进行。5.2.3重金属总量按照GB/T14233.1-2022中5.6.1的方法进行,其中镉含量按照GB/T14233.1-2022中5.9.1的方法进行。5.2.4溶剂残留5.2.4.1制造商应按照《中华人民共和国药典》(2020年版)限量检查法中残留溶剂测定法进行检验,或其他适合的方法用于相关检测。5.2.4.2戊二醛残留应参考《中华人民共和国药典》(2020年版)戊二醛残留量测定方法或其他经过方法学确认过的检验方法进行。5.3生物学性能5.3.1生物负载按照《中华人民共和国药典》(2020年版)通则中非无菌产品微生物限度检查:微生物计数法的方法进行。5.3.2细菌内毒素按照《中华人民共和国药典》(2020年版)通则中细菌内毒素检测法的方法进行检测。5.3.3生物学评价按照GB/T16886.1原则选择合适的标准进行检测或评价。5.3.4免疫原性评估应根据相应的免疫原性控制方案,选择适宜的方法进行检测或评价。5.3.5病毒灭活/去除有效性评估应根据材料特性制定病毒和/或传染性因子灭活确认方案,选择适宜的方法进行检测或评价。5.3.6抗钙化性能大鼠皮下植入模型按YY/T1859的方法进行。5.3.7抗降解性能应按照附录D的方法进行。5.3.8血小板功能应选用以下3种常见的方法之一进行评估:——评估血小板颗粒物质的含量,按照GB/T16886.4-2022中附录B.3.3中酶联免疫吸附测定(ELISA)试剂盒方法,或按照YY/T1649.2的方法进行;注:血小板颗粒物质即血小板激活产物,包β-血栓球蛋白/β-IG、血小板第4因子/PF4和血栓素B2/TxB2。——对血液中的血小板进行计数,按YY/T1649.1的方法进行;——按照附录E中的方法对血小板粘附在瓣叶上的黏附形态进行评估。5.3.9纤维蛋白原吸附采集制备时间小于4h的枸橼酸钠抗凝新鲜贫血小板血浆按3cm2/mL~6cm2/mL血浆的接触比与瓣叶及对照品在37℃下孵育15min±1min,使用血凝仪检测孵育溶液中纤维蛋白原的浓度。6报告报告至少应包括以下内容:——样品信息(如:名称、批号、工艺特点)、实验室名称、试验日期等信息;——评估项目;——使用的方法;——分析结果及其表示:数据结果应进行统计学分析(如:均值、极值、标准差及变异系数等);——试验偏离。
《 YY/T 1876-2023 组织工程医疗产品 动物源性生物材料DNA残留量测定法:荧光染色法 》标准简介
- 标准名称:组织工程医疗产品 动物源性生物材料DNA残留量测定法:荧光染色法
- 标准号:YY/T 1876-2023
- 中国标准分类号:C40
- 发布日期:2023-01-13
- 国际标准分类号:11.040.30
- 实施日期:2024-01-15
- 技术归口:
- 代替标准:YY/T 0606.25-2014
- 主管部门:国家药监局
- 标准分类:医药卫生技术医疗设备外科器械和材料医药卫生和社会工作
- 内容简介:
行业标准《组织工程医疗产品 动物源性生物材料DNA残留量测定法:荧光染色法》,主管部门为国家药监局。本文件规定了动物源性生物材料中DNA残留量的测定方法。本文件适用于动物源性生物材料及其衍生物的终产品或中间产品、用于组织工程医疗产品基质或支架的动物源性支架材料,也可用于人源脱细胞基质材料。
《 DB45/T 1488-2017 动物源性食品中兽药残留量的测定 液相色谱-串联质谱法 》标准简介
- 标准名称:动物源性食品中兽药残留量的测定 液相色谱-串联质谱法
- 标准号:DB45/T 1488-2017
- 中国标准分类号:X04
- 发布日期:2017-02-20
- 国际标准分类号:67.040
- 实施日期:2017-03-20
- 技术归口:
- 代替标准:
- 主管部门:广西壮族自治区质量技术监督局
- 标准分类:食品技术食品综合
- 内容简介:
地方标准《动物源性食品中兽药残留量的测定 液相色谱-串联质谱法》,主管部门为广西壮族自治区质量技术监督局。
《 NY/T 4031-2021 动物源性食品中住肉孢子虫检测方法 》标准简介
- 标准名称:动物源性食品中住肉孢子虫检测方法
- 标准号:NY/T 4031-2021
- 中国标准分类号:B41
- 发布日期:2021-12-15
- 国际标准分类号:11.220
- 实施日期:2022-06-01
- 技术归口:畜牧兽医局/全国动物卫生标准化技术委员会
- 代替标准:
- 主管部门:农业农村部
- 标准分类:农业医药卫生技术兽医学农、林、牧、渔业
- 内容简介:
行业标准《动物源性食品中住肉孢子虫检测方法》由畜牧兽医局/全国动物卫生标准化技术委员会归口上报,主管部门为农业农村部。
《 YY/T 1788-2021 外科植入物 动物源性补片类产品通用要求 》标准简介
- 标准名称:外科植入物 动物源性补片类产品通用要求
- 标准号:YY/T 1788-2021
- 中国标准分类号:C35
- 发布日期:2021-09-06
- 国际标准分类号:110.040.40
- 实施日期:2022-09-01
- 技术归口:
- 代替标准:
- 主管部门:国家药监局
- 标准分类:医药卫生和社会工作
- 内容简介:
行业标准《外科植入物 动物源性补片类产品通用要求》,主管部门为国家药监局。本标准规定了动物源性补片类产品的术语和定义、技术要求和试验方法。本标准适用于以动物源性组织及其衍生物为原材料、经特定工艺技术处理制备的补片类产品。
《 DB21/T 2742-2017 饲料中动物源性成分-貂源性组织成分定性检测方法PCR 方法 》标准简介
- 标准名称:饲料中动物源性成分-貂源性组织成分定性检测方法PCR 方法
- 标准号:DB21/T 2742-2017
- 中国标准分类号:B46
- 发布日期:2017-02-23
- 国际标准分类号:65.120
- 实施日期:2017-03-23
- 技术归口:
- 代替标准:
- 主管部门:辽宁省质量技术监督局
- 标准分类:农业饲料
- 内容简介:
地方标准《饲料中动物源性成分—貂源性组织成分定性检测方法PCR 方法》,主管部门为辽宁省质量技术监督局。
《 NY/T 3946-2021 动物源性食品中肌肽、鹅肌肽的测定 高效液相色谱法 》标准简介
- 标准名称:动物源性食品中肌肽、鹅肌肽的测定 高效液相色谱法
- 标准号:NY/T 3946-2021
- 中国标准分类号:B04
- 发布日期:2021-11-09
- 国际标准分类号:65.020.01
- 实施日期:2022-05-01
- 技术归口:农产品质量安全监管司/农业农村部农产品营养标准专家委员会
- 代替标准:
- 主管部门:农业农村部
- 标准分类:农业农业和林业农业和林业综合农、林、牧、渔业
- 内容简介:
行业标准《动物源性食品中肌肽、鹅肌肽的测定 高效液相色谱法》由农产品质量安全监管司/农业农村部农产品营养标准专家委员会归口上报,主管部门为农业农村部。
《 YY/T 1561-2017 组织工程医疗器械产品动物源性支架材料残留α-Gal抗原检测 》标准简介
- 标准名称:组织工程医疗器械产品动物源性支架材料残留α-Gal抗原检测
- 标准号:YY/T 1561-2017
- 中国标准分类号:C45
- 发布日期:2017-03-28
- 国际标准分类号:11.040.40
- 实施日期:2018-04-01
- 技术归口:全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会
- 代替标准:
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医疗设备医药卫生和社会工作外科植入物假体和矫形
- 内容简介:
行业标准《组织工程医疗器械产品动物源性支架材料残留α-Gal抗原检测》由全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会归口上报,主管部门为国家食品药品监督管理局。
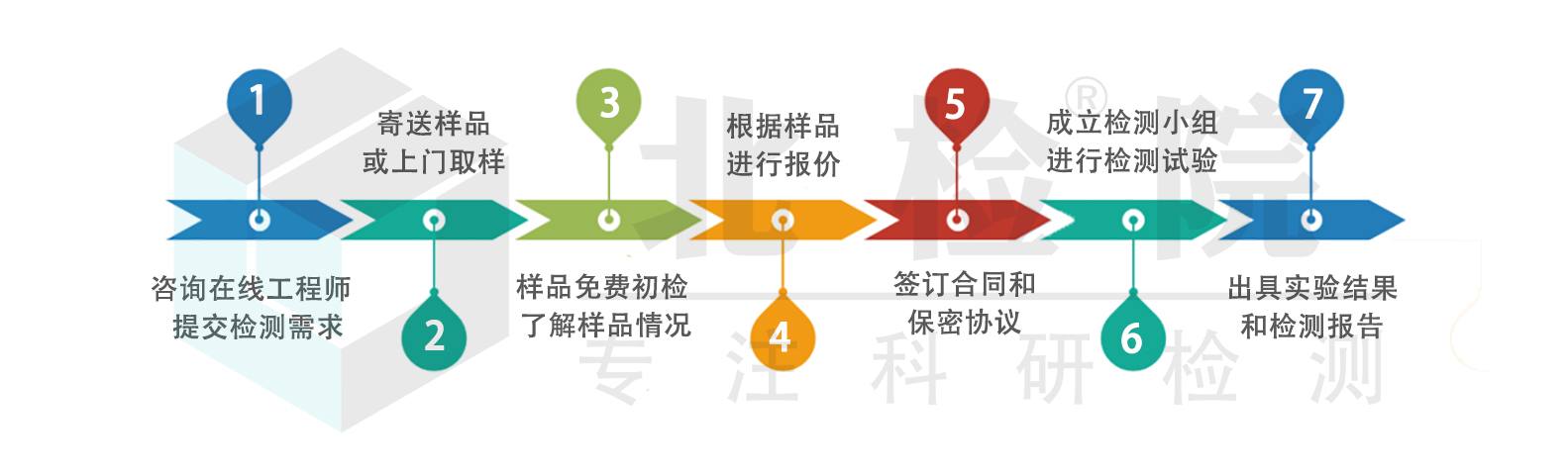
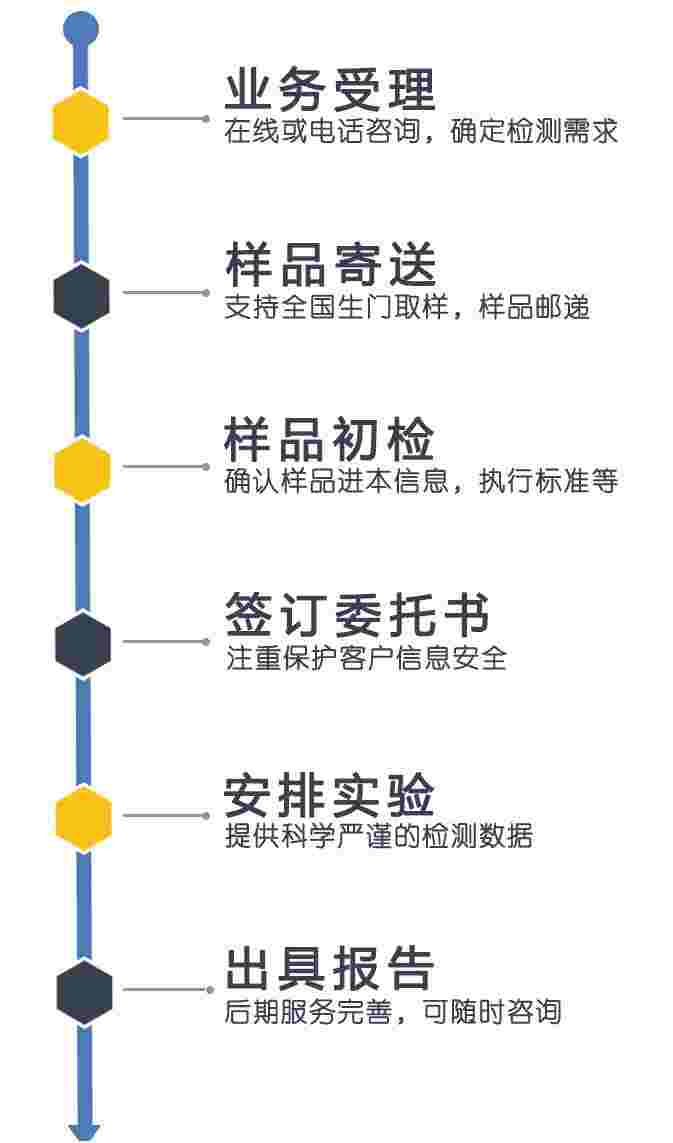
检测流程
检测优势
1、单位面向科研院所、学校和社会企业及科研单位,面向社会公共服务。
2、实验管理中心下设检测分析中心、科研测试中心、X射线应用中心。
3、面向物理、化学化工、材料、纳米、环境、电子、能源等众多学科。
4、拥有多台精密检测仪器设备。
5、能够从事材料微观结构分析、定性和定量分析、材料性能测定、材料质量综合评定等工作。
6、提供24小时开放服务、网络化的管理。
7、具备向校内外科学研究和品质鉴定提供公正、科研测试数据能力的重要机构。
检测实验室