标准列表(部分)
《 T/CAME 57-2023 新型冠状病毒核酸即时检验操作技术规程 》标准简介
- 标准名称:新型冠状病毒核酸即时检验操作技术规程
- 标准号:T/CAME 57-2023
- 中国标准分类号:/Q841
- 发布日期:2023-04-28
- 国际标准分类号:11.020
- 实施日期:2023-04-28
- 团体名称:中国医学装备协会
- 标准分类:医院
- 内容简介:
本文件规定了新型冠状病毒核酸即时检验的环境、设施与人员,设备、试剂与耗材,样本采集,检验程序,质量保证的要求。本文件适用于开展新型冠状病毒核酸即时检验的各级各类医疗卫生机构。
《 DB6101/T 3119-2022 新型冠状病毒核酸采样排队叫号信息系统建设指南 》标准简介
- 标准名称:新型冠状病毒核酸采样排队叫号信息系统建设指南
- 标准号:DB6101/T 3119-2022
- 中国标准分类号:L73
- 发布日期:2022-05-10
- 国际标准分类号:35.240.80
- 实施日期:2022-06-10
- 技术归口:西安市卫生健康委员会
- 代替标准:
- 主管部门:西安市
- 标准分类:信息技术办公机械信息技术应用信息技术在医药卫生技术中的应用
- 内容简介:
地方标准《新型冠状病毒核酸采样排队叫号信息系统建设指南》由西安市卫生健康委员会归口上报,主管部门为西安市。
《 DB6101/T 3118.2-2022 新型冠状病毒核酸标本采集 第2部分:采集方法 》标准简介
- 标准名称:新型冠状病毒核酸标本采集 第2部分:采集方法
- 标准号:DB6101/T 3118.2-2022
- 中国标准分类号:C61
- 发布日期:2022-05-10
- 国际标准分类号:11.1
- 实施日期:2022-06-10
- 技术归口:西安市卫生健康委员会
- 代替标准:
- 主管部门:西安市
- 标准分类:医药卫生技术
- 内容简介:
地方标准《新型冠状病毒核酸标本采集 第2部分:采集方法》由西安市卫生健康委员会归口上报,主管部门为西安市。
《 DB6101/T 3118.1-2022 新型冠状病毒核酸标本采集 第1部分:现场准备 》标准简介
- 标准名称:新型冠状病毒核酸标本采集 第1部分:现场准备
- 标准号:DB6101/T 3118.1-2022
- 中国标准分类号:C61
- 发布日期:2022-05-10
- 国际标准分类号:11.1
- 实施日期:2022-06-10
- 技术归口:西安市卫生健康委员会
- 代替标准:
- 主管部门:西安市
- 标准分类:医药卫生技术
- 内容简介:
地方标准《新型冠状病毒核酸标本采集 第1部分:现场准备》由西安市卫生健康委员会归口上报,主管部门为西安市。
《 DB36/T 1705-2022 新型冠状病毒核酸采样间管理规范 》标准简介
- 标准名称:新型冠状病毒核酸采样间管理规范
- 标准号:DB36/T 1705-2022
- 中国标准分类号:C52
- 发布日期:2022-12-13
- 国际标准分类号:13.100
- 实施日期:2022-12-13
- 技术归口:省卫生健康标准化技术委员会
- 代替标准:
- 主管部门:江西省市场监督管理局
- 标准分类:环保保健和安全职业安全工业卫生
- 内容简介:
地方标准《新型冠状病毒核酸采样间管理规范》由省卫生健康标准化技术委员会归口上报,主管部门为江西省市场监督管理局。
《 DB3202/T 1029-2022 新型冠状病毒核酸采样小屋管理规范 》标准简介
- 标准名称:新型冠状病毒核酸采样小屋管理规范
- 标准号:DB3202/T 1029-2022
- 中国标准分类号:C52
- 发布日期:2022-04-25
- 国际标准分类号:13.100
- 实施日期:2022-04-25
- 技术归口:无锡市卫生健康委员会
- 代替标准:
- 主管部门:无锡市市场监督管理局
- 标准分类:环保保健和安全职业安全工业卫生
- 内容简介:
地方标准《新型冠状病毒核酸采样小屋管理规范》由无锡市卫生健康委员会归口上报,主管部门为无锡市市场监督管理局。
《 YY/T 1824-2021 EB病毒核酸检测试剂盒(荧光PCR法) 》标准简介
- 标准名称:EB病毒核酸检测试剂盒(荧光PCR法)
- 标准号:YY/T 1824-2021
- 中国标准分类号:C44
- 发布日期:2021-12-06
- 国际标准分类号:11.100.10
- 实施日期:2022-12-01
- 技术归口:
- 代替标准:
- 主管部门:国家药监局
- 标准分类:医药卫生技术医药卫生和社会工作
- 内容简介:
行业标准《EB病毒核酸检测试剂盒(荧光PCR法)》,主管部门为国家药监局。本标准规定了EB病毒核酸检测试剂盒(荧光PCR法)(以下简称试剂盒)的要求、试验方法、标签和使用说明书、包装、运输和贮存。本标准适用于以荧光PCR法为原理,定性/定量检测人体全血、血清/血浆中EB病毒核酸的试剂盒。
《 DB21/T 2472-2015 H1N1亚型不同谱系猪流感病毒核酸RT-PCR鉴别诊断技术规范 》标准简介
- 标准名称:H1N1亚型不同谱系猪流感病毒核酸RT-PCR鉴别诊断技术规范
- 标准号:DB21/T 2472-2015
- 中国标准分类号:B41
- 发布日期:2015-04-30
- 国际标准分类号:11.220
- 实施日期:2015-06-30
- 技术归口:
- 代替标准:
- 主管部门:辽宁省质量技术监督局
- 标准分类:医药卫生技术兽医学
- 内容简介:
地方标准《H1N1亚型不同谱系猪流感病毒核酸RT-PCR鉴别诊断技术规范》,主管部门为辽宁省质量技术监督局。
《 DB21/T 2357-2014 A型口蹄疫病毒核酸RT-PCR检测方法 》标准简介
- 标准名称:A型口蹄疫病毒核酸RT-PCR检测方法
- 标准号:DB21/T 2357-2014
- 中国标准分类号:B41
- 发布日期:2014-07-29
- 国际标准分类号:11.220
- 实施日期:2014-09-29
- 技术归口:辽宁省畜牧兽医局
- 代替标准:
- 主管部门:辽宁省质量技术监督局
- 标准分类:医药卫生技术兽医学
- 内容简介:
地方标准《A型口蹄疫病毒核酸RT-PCR检测方法》由辽宁省畜牧兽医局归口上报,主管部门为辽宁省质量技术监督局。
《 T/LNEMA 003-2022 冷冻食品及加工环境新型冠状病毒核酸检测样本采集技术规范 》标准简介
- 标准名称:冷冻食品及加工环境新型冠状病毒核酸检测样本采集技术规范
- 标准号:T/LNEMA 003-2022
- 中国标准分类号:/M746
- 发布日期:2022-09-26
- 国际标准分类号:19.040
- 实施日期:2022-09-26
- 团体名称:辽宁省环境监测协会
- 标准分类:环境与生态监测
- 内容简介:
该标准规定了冷冻食品及加工环境新型冠状病毒核算检测样本采集的技术要求、过程要求和样本管理,适用于水产、肉类等冷冻冷藏食品;冷库库房等低温密闭潮湿空间;加工设备、操作台和加工环境;操作人员、废水等其他环境样本采集、运输和管理。
《 YY/T 1226-2022 人乳头瘤病毒核酸(分型)检测试剂盒 》标准简介
- 标准名称:人乳头瘤病毒核酸(分型)检测试剂盒
- 标准号:YY/T 1226-2022
- 中国标准分类号:C44
- 发布日期:2022-05-18
- 国际标准分类号:11.100
- 实施日期:2023-06-01
- 技术归口:
- 代替标准:YY/T 1226-2014
- 主管部门:国家药监局
- 标准分类:医药卫生技术实验室医学医药卫生和社会工作
- 内容简介:
行业标准《人乳头瘤病毒核酸(分型)检测试剂盒》,主管部门为国家药监局。本文件规定了人乳头瘤病毒核酸(分型)检测试剂盒的术语和定义、技术要求、试验方法、标识、标签和使用说明书、包装、运输、贮存等。本文件适用于预期用途为人乳头瘤病毒核酸(Humanpapillomavirus,HPV)感染的辅助诊断和(或)宫颈癌筛查用的人乳头瘤病毒核酸(分型)检测试剂盒,适用的检测方法包括PCR荧光法、PCR-反向杂交法、杂交捕获-化学发光法、酶切信号放大法、基因芯片法、高通量测序等。
《 YY/T 1596-2017 甲型流感病毒核酸检测试剂盒(荧光PCR法) 》标准简介
- 标准名称:甲型流感病毒核酸检测试剂盒(荧光PCR法)
- 标准号:YY/T 1596-2017
- 中国标准分类号:C44
- 发布日期:2017-12-05
- 国际标准分类号:11.1
- 实施日期:2018-12-01
- 技术归口:全国医用临床检验实验室和体外诊断系统标准化技术委员会
- 代替标准:
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药卫生和社会工作
- 内容简介:
行业标准《甲型流感病毒核酸检测试剂盒(荧光PCR法)》由全国医用临床检验实验室和体外诊断系统标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
《 YY/T 1226-2014 人乳头瘤病毒核酸(分型)检测试剂(盒) 》标准简介
- 标准名称:人乳头瘤病毒核酸(分型)检测试剂(盒)
- 标准号:YY/T 1226-2014
- 中国标准分类号:C44
- 发布日期:2014-06-17
- 国际标准分类号:11.100
- 实施日期:2015-07-01
- 技术归口:
- 代替标准:
- 主管部门:国家药监局
- 标准分类:医药卫生技术实验室医学医药卫生和社会工作
- 内容简介:
行业标准《人乳头瘤病毒核酸(分型)检测试剂(盒)》,主管部门为国家药监局。本标准适用于人乳头瘤病毒核酸(分型)检测试剂(盒),采用的技术方法有实时PCR荧光法、PCR-反向杂交法、表面等离子谐振法、杂交捕获-化学发光法、酶切信号放大法、基因芯片法等。本标准规定了人乳头瘤病毒核酸(分型)检测试剂(盒)的术语和定义、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等内容。
《 GB/T 40982-2021 新型冠状病毒核酸检测试剂盒质量评价要求 》标准简介
- 标准名称:新型冠状病毒核酸检测试剂盒质量评价要求
- 标准号:GB/T 40982-2021
- 中国标准分类号:C44
- 发布日期:2021-11-26
- 国际标准分类号:11.100.10
- 实施日期:2022-03-01
- 技术归口:全国医用临床检验实验室和体外诊断系统标准化技术委员会
- 代替标准:
- 主管部门:国家药品监督管理局
- 标准分类:医药卫生技术
- 内容简介:
国家标准《新型冠状病毒核酸检测试剂盒质量评价要求》由TC136(全国医用临床检验实验室和体外诊断系统标准化技术委员会)归口上报及执行,主管部门为国家药品监督管理局。
《 T/GDMDMA 0002-2021 呼吸道病毒核酸检测用质控物 通用技术要求 》标准简介
- 标准名称:呼吸道病毒核酸检测用质控物 通用技术要求
- 标准号:T/GDMDMA 0002-2021
- 中国标准分类号:/C2770
- 发布日期:2021-05-25
- 国际标准分类号:11.100
- 实施日期:2021-05-25
- 团体名称:广东省医疗器械管理学会
- 标准分类:卫生材料及医药用品制造
- 内容简介:
本标准规定了呼吸道病毒核酸检测用质控物通用技术要求、评价指标和评价方法等本标准适用于呼吸道病毒核酸检测用质控物的性能评价,呼吸道病毒包括:严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)、甲型流感病毒(IVA)、乙型流感病毒(IVB)、呼吸道合胞病毒、腺病毒(ADV)、副流感病毒、人冠状病毒等本标准不适用于:a)微生物、免疫组化、分子病理学、形态学等检测用的质控物;b)非呼吸道病毒的其它病原体微生物质控物原材料要求、分装要求、互换性与基质效应要求、均匀性要求、稳定性要求、溯源性要求、特性量值赋值要求
检测流程
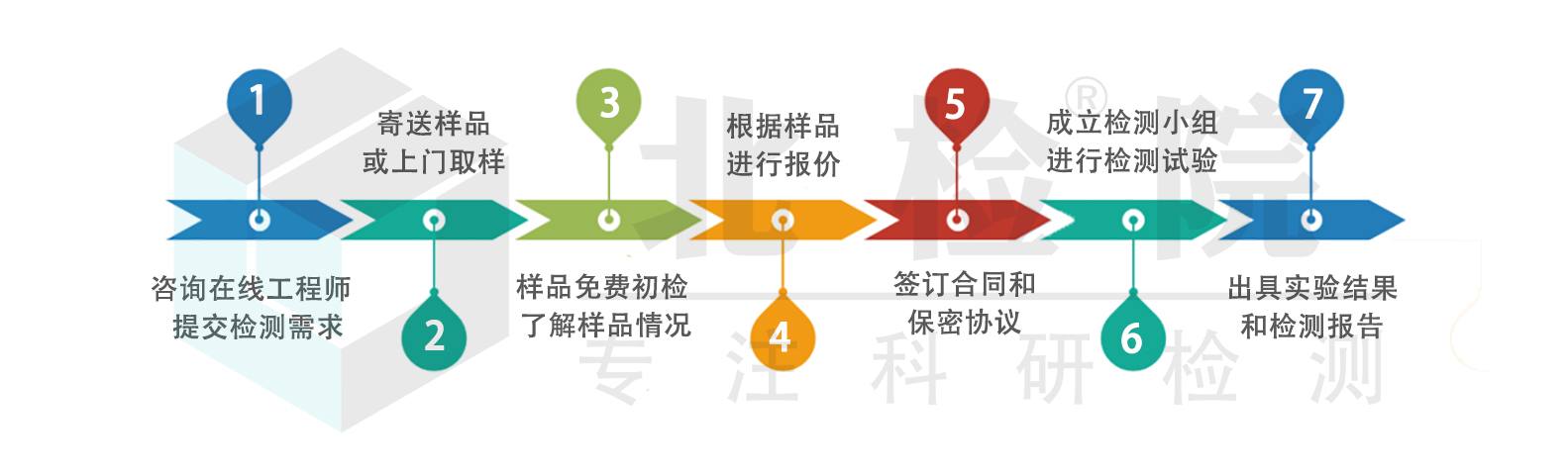
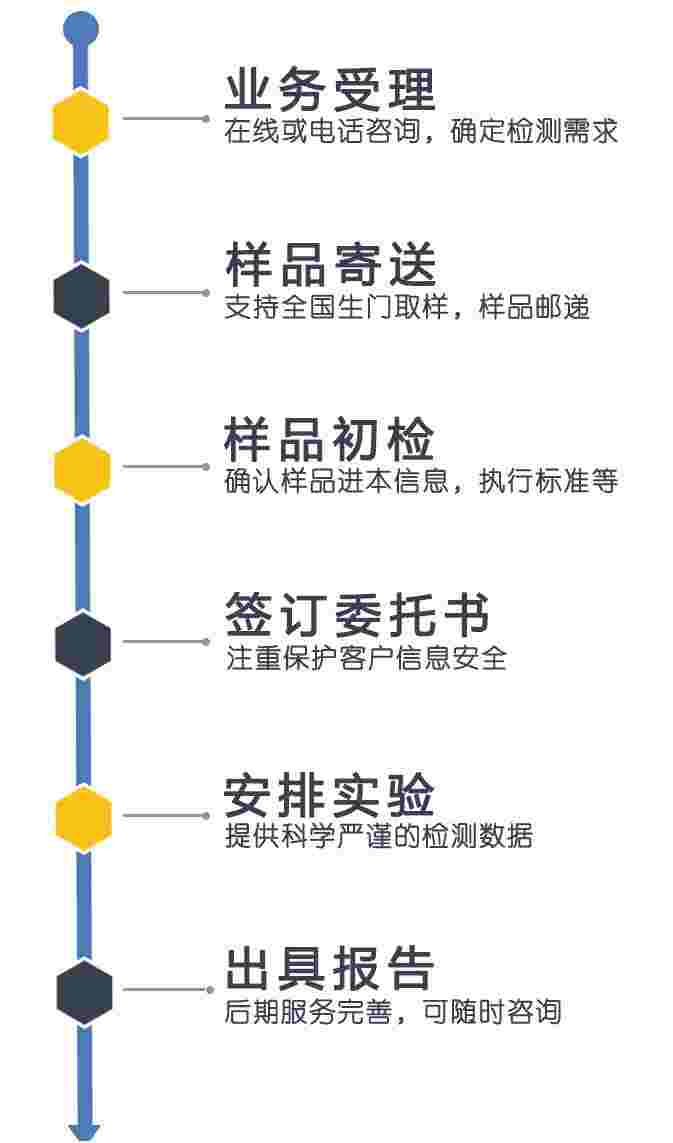
检测优势
1、单位面向科研院所、学校和社会企业及科研单位,面向社会公共服务。
2、实验管理中心下设检测分析中心、科研测试中心、X射线应用中心。
3、面向物理、化学化工、材料、纳米、环境、电子、能源等众多学科。
4、拥有多台精密检测仪器设备。
5、能够从事材料微观结构分析、定性和定量分析、材料性能测定、材料质量综合评定等工作。
6、提供24小时开放服务、网络化的管理。
7、具备向校内外科学研究和品质鉴定提供公正、科研测试数据能力的重要机构。
检测实验室