标准列表(部分)
《 YY/T 0127.13-2018 口腔医疗器械生物学评价 第13部分:口腔黏膜刺激试验 》标准简介
- 标准名称:口腔医疗器械生物学评价 第13部分:口腔黏膜刺激试验
- 标准号:YY/T 0127.13-2018
- 中国标准分类号:C33
- 发布日期:2018-04-11
- 国际标准分类号:11.060.10
- 实施日期:2019-05-01
- 技术归口:全国口腔材料和器械设备标准化技术委员会
- 代替标准:YY/T0127.13-2009
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药卫生和社会工作牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第13部分:口腔黏膜刺激试验》由全国口腔材料和器械设备标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
《 YY/T 0127.7-2017 口腔医疗器械生物学评价第7部分:牙髓牙本质应用试验 》标准简介
- 标准名称:口腔医疗器械生物学评价第7部分:牙髓牙本质应用试验
- 标准号:YY/T 0127.7-2017
- 中国标准分类号:C33
- 发布日期:2017-03-28
- 国际标准分类号:11.060.10
- 实施日期:2018-04-01
- 技术归口:全国口腔材料和器械设备标准化技术委员会
- 代替标准:YY/T0127.7-2001
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药卫生和社会工作牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价第7部分:牙髓牙本质应用试验》由全国口腔材料和器械设备标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
《 YY/T 0127.18-2016 口腔医疗器械生物学评价 第18部分: 牙本质屏障细胞毒性试验 》标准简介
- 标准名称:口腔医疗器械生物学评价 第18部分: 牙本质屏障细胞毒性试验
- 标准号:YY/T 0127.18-2016
- 中国标准分类号:C33
- 发布日期:2016-01-26
- 国际标准分类号:11.060.10
- 实施日期:2017-01-01
- 技术归口:全国口腔材料和器械设备标准化技术委员会
- 代替标准:
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药卫生和社会工作牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第18部分: 牙本质屏障细胞毒性试验》由全国口腔材料和器械设备标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。本标准规定了口腔材料牙本质屏障细胞毒性试验方法。本标准适用于评价牙体充填材料和牙齿窝洞治疗的相关材料及其可滤沥成分经牙本质屏障后对细胞毒性的影响。
《 YY/T 0127.3-2014 口腔医疗器械生物学评价 第3部分:根管内应用试验 》标准简介
- 标准名称:口腔医疗器械生物学评价 第3部分:根管内应用试验
- 标准号:YY/T 0127.3-2014
- 中国标准分类号:C33
- 发布日期:2014-06-17
- 国际标准分类号:11.060.10
- 实施日期:2015-07-01
- 技术归口:
- 代替标准:YY/T0127.3-1998
- 主管部门:国家药监局
- 标准分类:医药卫生技术医药卫生和社会工作牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第3部分:根管内应用试验》,主管部门为国家药监局。本标准适用于评价根尖区牙髓断端组织及根尖周组织对根管内材料的生物相容性。材料在临床应用中所必需的操作过程亦包含在此评价中。本标准规定了口腔材料根管内应用试验方法。
《 YY/T 0127.11-2014 口腔医疗器械生物学评价 第11部分:盖髓试验 》标准简介
- 标准名称:口腔医疗器械生物学评价 第11部分:盖髓试验
- 标准号:YY/T 0127.11-2014
- 中国标准分类号:C33
- 发布日期:2014-06-17
- 国际标准分类号:11.060.10
- 实施日期:2015-07-01
- 技术归口:
- 代替标准:YY/T0127.11-2001
- 主管部门:国家药监局
- 标准分类:医药卫生技术医药卫生和社会工作牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第11部分:盖髓试验》,主管部门为国家药监局。本标准适用于评价盖髓材料与牙髓的生物相容性。材料在临床应用中所需的操作方法和过程亦包含在此评价中。本标准规定了口腔材料盖髓试验方法。
《 YY/T 0268-2008 牙科学 口腔医疗器械生物学评价 第1单元:评价与试验 》标准简介
- 标准名称:牙科学 口腔医疗器械生物学评价 第1单元:评价与试验
- 标准号:YY/T 0268-2008
- 中国标准分类号:C33
- 发布日期:2008-04-25
- 国际标准分类号:11.060.01
- 实施日期:2009-06-01
- 技术归口:全国口腔材料和器械标准化技术委员会
- 代替标准:YY/T0268-2001
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药牙科牙科综合
- 内容简介:
行业标准《牙科学 口腔医疗器械生物学评价 第1单元:评价与试验》由全国口腔材料和器械标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
《 YY/T 0127.9-2009 口腔医疗器械生物学评价 第2单元: 试验方法 细胞毒性试验:琼脂扩散法及滤膜扩散法 》标准简介
- 标准名称:口腔医疗器械生物学评价 第2单元: 试验方法 细胞毒性试验:琼脂扩散法及滤膜扩散法
- 标准号:YY/T 0127.9-2009
- 中国标准分类号:
- 发布日期:2009-12-30
- 国际标准分类号:
- 实施日期:2011-06-01
- 技术归口:
- 代替标准:替代YY/T0127.9-2001
- 主管部门:国家食品药品监督管理局
- 标准分类:
- 内容简介:
《 YY/T 0127.12-2008 牙科学 口腔医疗器械生物学评价 第2单元:试验方法 微核试验 》标准简介
- 标准名称:牙科学 口腔医疗器械生物学评价 第2单元:试验方法 微核试验
- 标准号:YY/T 0127.12-2008
- 中国标准分类号:C33
- 发布日期:2008-04-25
- 国际标准分类号:11.060.01
- 实施日期:2009-06-01
- 技术归口:全国口腔材料和器械标准化技术委员会
- 代替标准:
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药牙科牙科综合
- 内容简介:
行业标准《牙科学 口腔医疗器械生物学评价 第2单元:试验方法 微核试验》由全国口腔材料和器械标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
《 YY/T 0127.13-2009 口腔医疗器械生物学评价 第2单元:试验方法 口腔粘膜刺激试验 》标准简介
- 标准名称:口腔医疗器械生物学评价 第2单元:试验方法 口腔粘膜刺激试验
- 标准号:YY/T 0127.13-2009
- 中国标准分类号:C33
- 发布日期:2009-06-16
- 国际标准分类号:11.060.10
- 实施日期:2010-12-01
- 技术归口:全国口腔材料和器械标准化技术委员会
- 代替标准:YY/T279-1995
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第2单元:试验方法 口腔粘膜刺激试验》由全国口腔材料和器械标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
《 YY/T 0127.10-2009 口腔医疗器械生物学评价 第2单元:试验方法 鼠伤寒沙门氏杆菌回复突变试验(Ames试验) 》标准简介
- 标准名称:口腔医疗器械生物学评价 第2单元:试验方法 鼠伤寒沙门氏杆菌回复突变试验(Ames试验)
- 标准号:YY/T 0127.10-2009
- 中国标准分类号:C33
- 发布日期:2009-06-16
- 国际标准分类号:11.060.10
- 实施日期:2010-12-01
- 技术归口:全国口腔材料和器械标准化技术委员会
- 代替标准:YY/T0127.10-2001
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医药牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第2单元:试验方法 鼠伤寒沙门氏杆菌回复突变试验(Ames试验)》由全国口腔材料和器械标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。
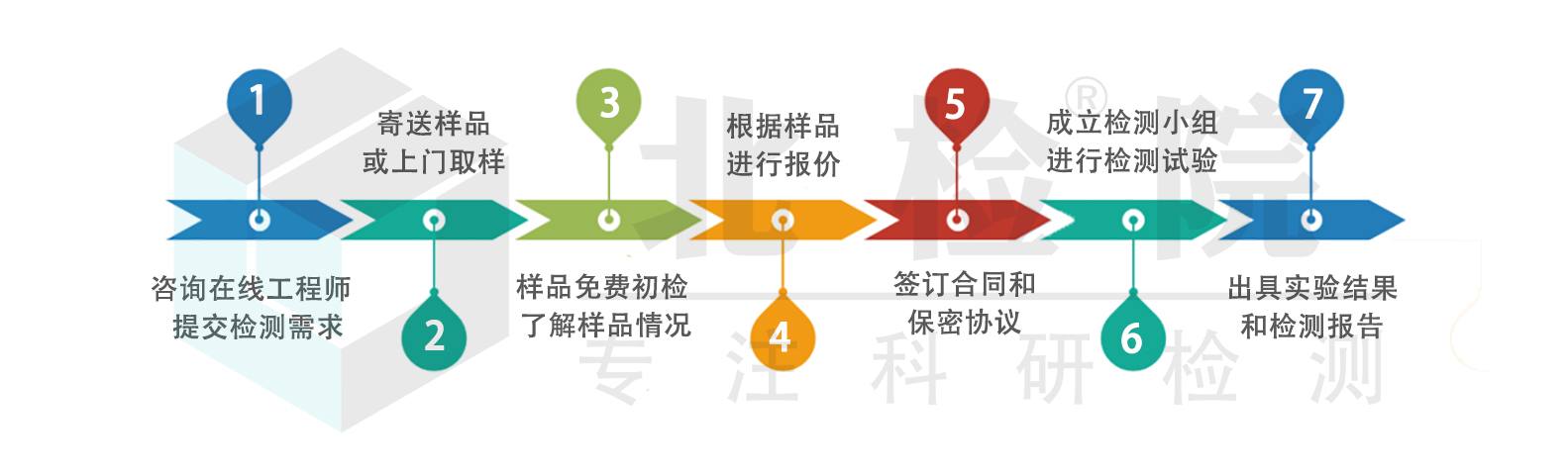
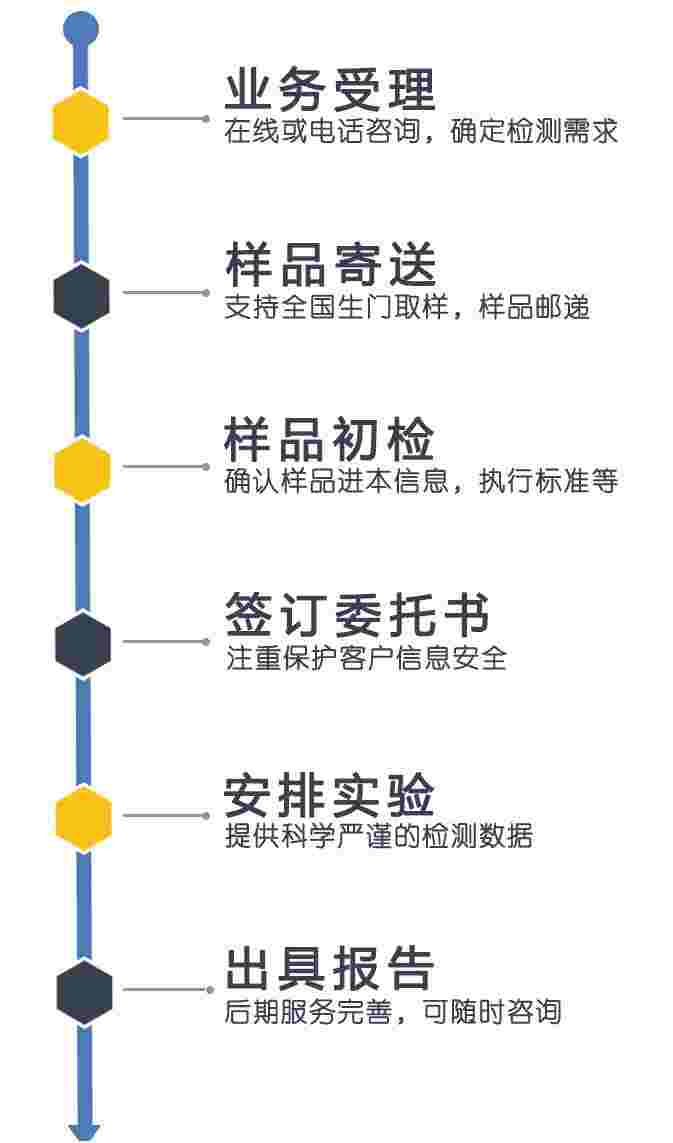
检测流程
检测优势
1、单位面向科研院所、学校和社会企业及科研单位,面向社会公共服务。
2、实验管理中心下设检测分析中心、科研测试中心、X射线应用中心。
3、面向物理、化学化工、材料、纳米、环境、电子、能源等众多学科。
4、拥有多台精密检测仪器设备。
5、能够从事材料微观结构分析、定性和定量分析、材料性能测定、材料质量综合评定等工作。
6、提供24小时开放服务、网络化的管理。
7、具备向校内外科学研究和品质鉴定提供公正、科研测试数据能力的重要机构。
检测实验室