标准列表(部分)
《 YY/T 1282-2022 一次性使用静脉留置针 》标准简介
- 标准名称:一次性使用静脉留置针
- 标准号:YY/T 1282-2022
- 中国标准分类号:C31
- 发布日期:2022-05-18
- 国际标准分类号:11.040.20
- 实施日期:2023-06-01
- 技术归口:
- 代替标准:YY 1282-2016
- 主管部门:国家药监局
- 标准分类:医药卫生技术医疗设备医药卫生和社会工作输血输液和注射设备
- 内容简介:
行业标准《一次性使用静脉留置针》,主管部门为国家药监局。本文件规定了供插入人体的外周静脉系统输液或输血的一次性使用静脉留置针(以下简称留置针)的要求,以保证与相应的输液、输血器具相适应。本文件适用于插入人体的外周静脉系统用以输液或输血的留置针。
《 YY 1282-2016 一次性使用静脉留置针 》标准简介
- 标准名称:一次性使用静脉留置针
- 标准号:YY 1282-2016
- 中国标准分类号:C31
- 发布日期:2016-03-23
- 国际标准分类号:11.040.20
- 实施日期:2018-01-01
- 技术归口:全国医用输液器具标准化技术委员会
- 代替标准:
- 主管部门:国家食品药品监督管理局
- 标准分类:医药卫生技术医疗设备医药卫生和社会工作输血输液和注射设备
- 内容简介:
行业标准《一次性使用静脉留置针》由全国医用输液器具标准化技术委员会归口上报,主管部门为国家食品药品监督管理局。本标准适用于插入人体外周血管静脉系统用以输液或输血的留置针。本标准规定了供插入人体的外周血管静脉系统输液或输血的一次性使用静脉留置针的要求,以保证与相应的输液、输血器具相适应。
《 T/CAMDI 007-2016 -次性使用静脉留置针导管 》标准简介
- 标准名称:-次性使用静脉留置针导管
- 标准号:T/CAMDI 007-2016
- 中国标准分类号:/Q842
- 发布日期:2016-12-22
- 国际标准分类号:11.020
- 实施日期:2017-07-01
- 团体名称:中国医疗器械行业协会
- 标准分类:不提供住宿社会工作
- 内容简介:
本标准按照GB/T1.1-2009规则起草。本标准规定以非无菌状态提供的一次性使用静脉留置针导管;本标准未提及灭菌要求,在产品包装及标识的内容相对成品器械有所删减。本标准未规定产品初始污染菌的要求,制造商根据相关法规和/或经验证的质量标准进行控制。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。
《 T/CAMDI 020-2019 -次性使用静脉留置针橡胶隔离塞 》标准简介
- 标准名称:-次性使用静脉留置针橡胶隔离塞
- 标准号:T/CAMDI 020-2019
- 中国标准分类号:/Q849
- 发布日期:2019-01-01
- 国际标准分类号:11.020
- 实施日期:2019-07-01
- 团体名称:中国医疗器械行业协会
- 标准分类:其他卫生活动
- 内容简介:
一次性使用静脉留置针产品供插入人体外周血管静脉系统进行输液之用,该产品已在国内外得到了广泛应用,留置针隔离塞作为装配在一次性使用静脉留置针导管座中防止血液渗出的橡胶件,属于主要配件。目前国内没有相应的国家标准或行业标准,随着科学技术的发展和对临床安全要求提高,需要拟定统一标准以适应市场监管要求。为了更加有效的对一次性使用静脉留置针橡胶隔离塞进行质量控制,便于一次性使用静脉留置针生产企业的使用。一次性使用静脉留置针橡胶隔离塞质量标准中,项目的设立是在参考一次性使用静脉留置针(YY1282-2016)、一次性使用输液器重力输液式(GB8368-2018)、医疗器械生物学评价(GB/T16886)、医用输液、输血、注射器具检验方法(GB/T14233)、一次性使用注射器用活塞(YY/T0243-2016)的基础上,按照标准化工作导则第1部分:标准的结构和编写规则(GB1.1-2009)编写格式进行起草的。
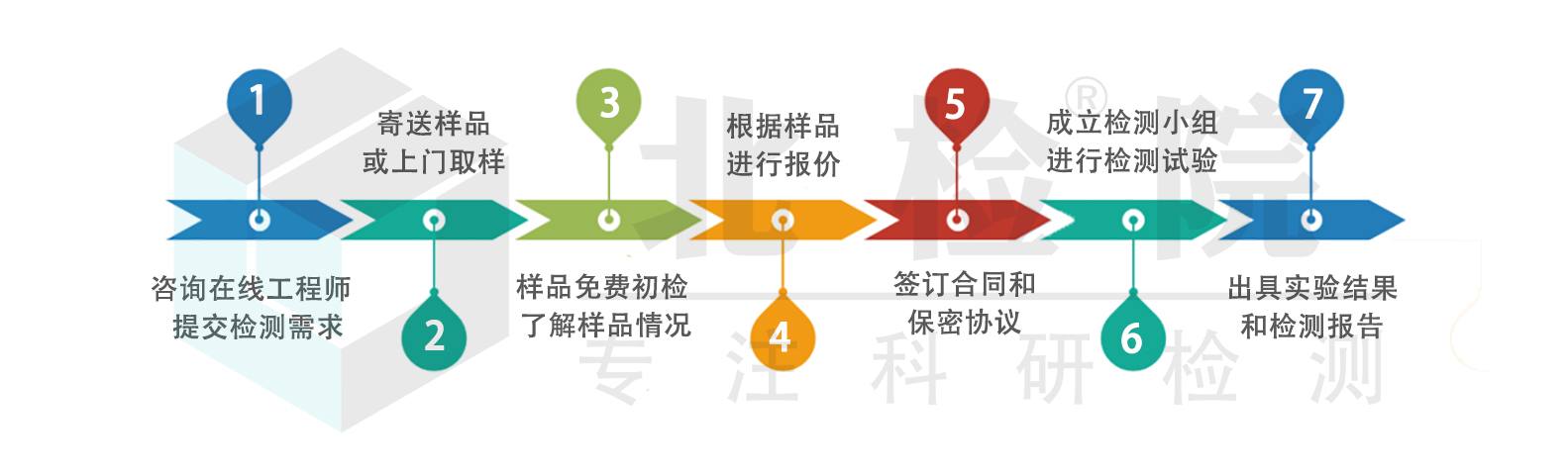
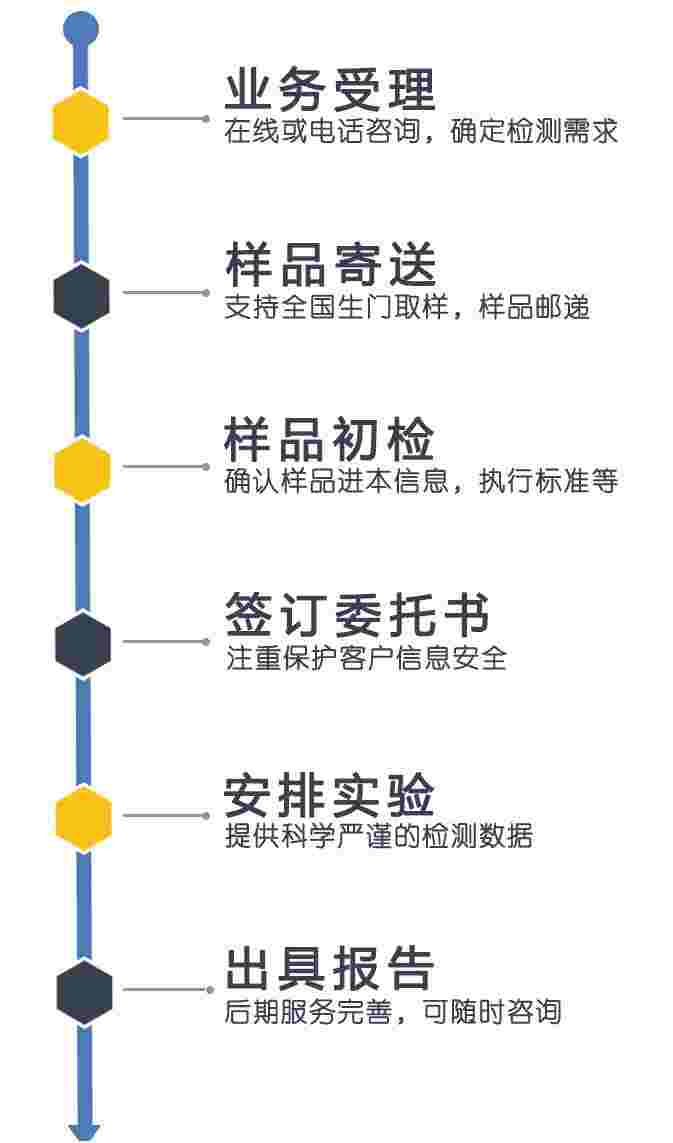
检测流程
检测优势
1、单位面向科研院所、学校和社会企业及科研单位,面向社会公共服务。
2、实验管理中心下设检测分析中心、科研测试中心、X射线应用中心。
3、面向物理、化学化工、材料、纳米、环境、电子、能源等众多学科。
4、拥有多台精密检测仪器设备。
5、能够从事材料微观结构分析、定性和定量分析、材料性能测定、材料质量综合评定等工作。
6、提供24小时开放服务、网络化的管理。
7、具备向校内外科学研究和品质鉴定提供公正、科研测试数据能力的重要机构。
检测实验室