标准列表(部分)
《 YY/T 0870.3-2019 医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的TK基因突变试验 》标准简介
- 标准名称:医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的TK基因突变试验
- 标准号:YY/T 0870.3-2019
- 中国标准分类号:C30
- 发布日期:2019-07-24
- 国际标准分类号:11.040.01
- 实施日期:2020-08-01
- 技术归口:
- 代替标准:YY/T 0870.3-2013
- 主管部门:国家药监局
- 标准分类:医药卫生技术医疗设备医药卫生和社会工作医疗设备综合
- 内容简介:
行业标准《医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的TK基因突变试验》,主管部门为国家药监局。本标准规定了使用小鼠淋巴瘤细胞系(L5178YTK+/-3.7.2C)进行医疗器械/材料体外哺乳动物细胞基因突变试验的方法。本标准适用于采用微孔板法,使用小鼠淋巴瘤细胞系(L5178YTK+/-3.7.2C)进行TK基因突变试验,采用相对存活率(RS)和相对总生长(RTG)两种指标来评估细胞毒性的方法。本标准代替YY/T0870.3-2013《医疗器械遗传毒性试验第3部分:用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验》。
《 SN/T 5159-2019 化学品 转基因啮齿类动物体细胞和生殖细胞基因突变试验 》标准简介
- 标准名称:化学品 转基因啮齿类动物体细胞和生殖细胞基因突变试验
- 标准号:SN/T 5159-2019
- 中国标准分类号:A80
- 发布日期:2019-10-25
- 国际标准分类号:11.100
- 实施日期:2020-05-01
- 技术归口:中华人民共和国海关总署
- 代替标准:
- 主管部门:海关总署
- 标准分类:医药卫生技术实验室医学制造业出入境检验检疫
- 内容简介:
行业标准《化学品 转基因啮齿类动物体细胞和生殖细胞基因突变试验》由中华人民共和国海关总署归口上报,主管部门为海关总署。
《 YY/T 0127.17-2014 口腔医疗器械生物学评价 第17部分:小鼠淋巴瘤细胞(TK)基因突变试验 》标准简介
- 标准名称:口腔医疗器械生物学评价 第17部分:小鼠淋巴瘤细胞(TK)基因突变试验
- 标准号:YY/T 0127.17-2014
- 中国标准分类号:C33
- 发布日期:2014-06-17
- 国际标准分类号:11.060.10
- 实施日期:2015-07-01
- 技术归口:
- 代替标准:
- 主管部门:国家药监局
- 标准分类:医药卫生技术医药卫生和社会工作牙科牙科材料
- 内容简介:
行业标准《口腔医疗器械生物学评价 第17部分:小鼠淋巴瘤细胞(TK)基因突变试验》,主管部门为国家药监局。本标准适用于测定口腔医疗器械的致突变性。本标准规定了口腔医疗器械小鼠淋巴瘤细胞(TK)基因突变试验方法,包括操作步骤,数据处理和结果判定。
《 YY/T 0870.3-2013 医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验 》标准简介
- 标准名称:医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验
- 标准号:YY/T 0870.3-2013
- 中国标准分类号:C30
- 发布日期:2013-10-21
- 国际标准分类号:11.040.01
- 实施日期:2014-10-01
- 技术归口:全国医疗器械生物学评价标准化技术委员会
- 代替标准:
- 主管部门:国家食品药品监督管理总局
- 标准分类:医药卫生技术医疗设备医疗设备综合医药
- 内容简介:
行业标准《医疗器械遗传毒性试验 第3部分:用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验》由全国医疗器械生物学评价标准化技术委员会归口上报,主管部门为国家食品药品监督管理总局。
《 GB 15193.20-2003 TK基因突变试验 》标准简介
- 标准名称:TK基因突变试验
- 标准号:GB 15193.20-2003
- 中国标准分类号:C53
- 发布日期:2003-09-24
- 国际标准分类号:07.100.30
- 实施日期:2004-05-01
- 技术归口:国家卫生健康委员会
- 代替标准:
- 主管部门:国家卫生健康委员会
- 标准分类:数学自然科学微生物学食品微生物学
- 内容简介:
国家标准《TK基因突变试验》由361(国家卫生健康委员会)归口上报及执行,主管部门为国家卫生健康委员会。
《 GB 15193.12-2003 体外哺乳类细胞(V79/HGPRT)基因突变试验 》标准简介
- 标准名称:体外哺乳类细胞(V79/HGPRT)基因突变试验
- 标准号:GB 15193.12-2003
- 中国标准分类号:C53
- 发布日期:2003-09-24
- 国际标准分类号:07.100.30
- 实施日期:2004-05-01
- 技术归口:国家卫生健康委员会
- 代替标准:GB15193.12-1994
- 主管部门:国家卫生健康委员会
- 标准分类:数学自然科学微生物学食品微生物学
- 内容简介:
国家标准《体外哺乳类细胞(V79/HGPRT)基因突变试验》由361(国家卫生健康委员会)归口上报及执行,主管部门为国家卫生健康委员会。
《 GB 15193.12-2014 食品安全国家标准 体外哺乳类细胞HGPRT基因突变试验 》标准简介
- 标准名称:食品安全国家标准 体外哺乳类细胞HGPRT基因突变试验
- 标准号:GB 15193.12-2014
- 中国标准分类号:
- 发布日期:2014-12-24
- 国际标准分类号:
- 实施日期:2015-05-01
- 技术归口:
- 代替标准:替代GB15193.12-2003
- 主管部门:国家卫生和计划生育委员会
- 标准分类:数学自然科学微生物学食品微生物学
- 内容简介:
本标准规定了体外哺乳类细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT)基因突变试验的基本试验方法和技术要求。本标准适用于评价受试物的致突变作用。
《 GB 15193.20-2014 食品安全国家标准 体外哺乳类细胞TK基因突变试验 》标准简介
- 标准名称:食品安全国家标准 体外哺乳类细胞TK基因突变试验
- 标准号:GB 15193.20-2014
- 中国标准分类号:
- 发布日期:2014-12-24
- 国际标准分类号:
- 实施日期:2015-05-01
- 技术归口:
- 代替标准:替代GB15193.20-2003
- 主管部门:国家卫生和计划生育委员会
- 标准分类:数学自然科学微生物学食品微生物学
- 内容简介:
本标准规定了体外哺乳类胸苷激酶(thymidine kinase,TK)基因突变试验的基本试验方法与技术要求。本标准适用于评价受试物的致突变作用。
《 GB/T 15670.20-2017 农药登记毒理学试验方法 第20部分:体外哺乳动物细胞基因突变试验 》标准简介
- 标准名称:农药登记毒理学试验方法 第20部分:体外哺乳动物细胞基因突变试验
- 标准号:GB/T 15670.20-2017
- 中国标准分类号:B17
- 发布日期:2017-07-12
- 国际标准分类号:65.100
- 实施日期:2018-02-01
- 技术归口:农业农村部
- 代替标准:
- 主管部门:农业农村部
- 标准分类:农业杀虫剂和其他农用化工产品
- 内容简介:
国家标准《农药登记毒理学试验方法 第20部分:体外哺乳动物细胞基因突变试验》由326(农业农村部)归口上报及执行,主管部门为农业农村部。
《 GB/T 21793-2008 化学品 体外哺乳动物细胞基因突变试验方法 》标准简介
- 标准名称:化学品 体外哺乳动物细胞基因突变试验方法
- 标准号:GB/T 21793-2008
- 中国标准分类号:A80
- 发布日期:2008-05-12
- 国际标准分类号:11.100
- 实施日期:2008-09-01
- 技术归口:全国危险化学品管理标准化技术委员会
- 代替标准:
- 主管部门:国家标准化管理委员会
- 标准分类:医药卫生技术实验室医学
- 内容简介:
国家标准《化学品 体外哺乳动物细胞基因突变试验方法》由TC251(全国危险化学品管理标准化技术委员会)归口上报,TC251SC1(全国危险化学品管理标准化技术委员会化学品毒性检测分会)执行,主管部门为国家标准化管理委员会。
《 GB/T 27831-2011 化学品 遗传毒性 酿酒酵母菌基因突变试验方法 》标准简介
- 标准名称:化学品 遗传毒性 酿酒酵母菌基因突变试验方法
- 标准号:GB/T 27831-2011
- 中国标准分类号:A80
- 发布日期:2011-12-30
- 国际标准分类号:11.100
- 实施日期:2012-08-01
- 技术归口:全国危险化学品管理标准化技术委员会
- 代替标准:
- 主管部门:国家标准化管理委员会
- 标准分类:医药卫生技术实验室医学
- 内容简介:
国家标准《化学品 遗传毒性 酿酒酵母菌基因突变试验方法》由TC251(全国危险化学品管理标准化技术委员会)归口上报,TC251SC1(全国危险化学品管理标准化技术委员会化学品毒性检测分会)执行,主管部门为国家标准化管理委员会。
《 GBZ/T 240.10-2011 化学品毒理学评价程序和试验方法 第10部分:体外哺乳动物细胞基因突变试验 》标准简介
- 标准名称:化学品毒理学评价程序和试验方法 第10部分:体外哺乳动物细胞基因突变试验
- 标准号:GBZ/T 240.10-2011
- 中国标准分类号:C52
- 发布日期:2011-08-19
- 国际标准分类号:13.100
- 实施日期:2012-03-01
- 技术归口:
- 代替标准:
- 主管部门:卫生部
- 标准分类:医药卫生劳动保护劳动卫生
- 内容简介:
GBZ/T 240的本部分规定了体外哺乳动物细胞基因突变试验的目的、试验概述、试验方法、数据处理与结果评价、评价报告和结果解释。本部分适用于检测化学品引起的体外哺乳动物细胞基因突变。
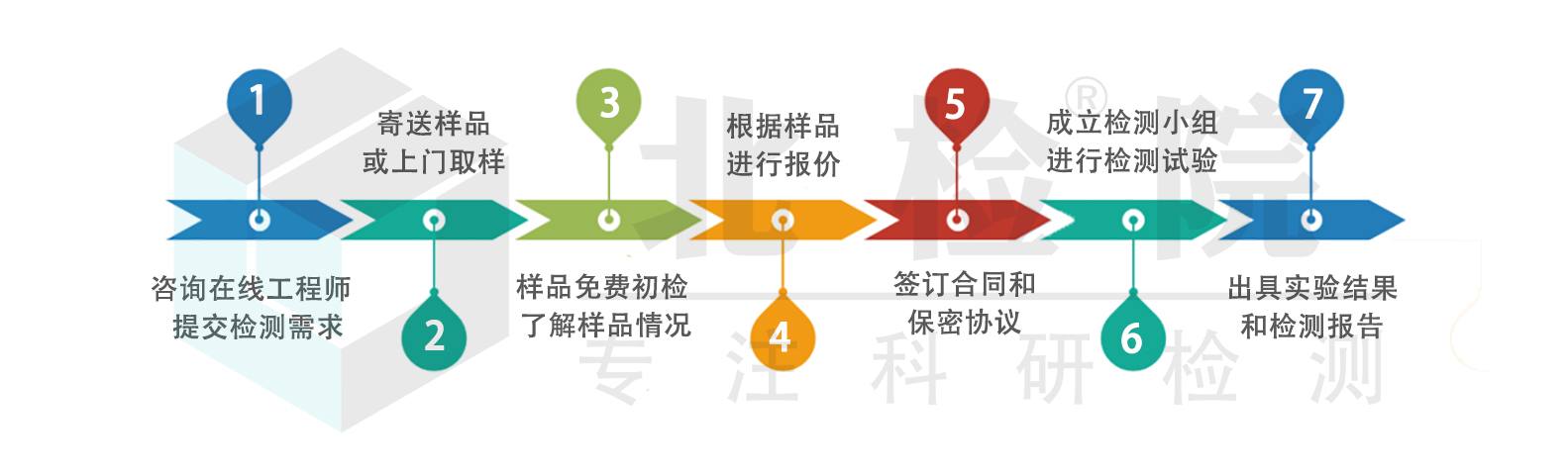
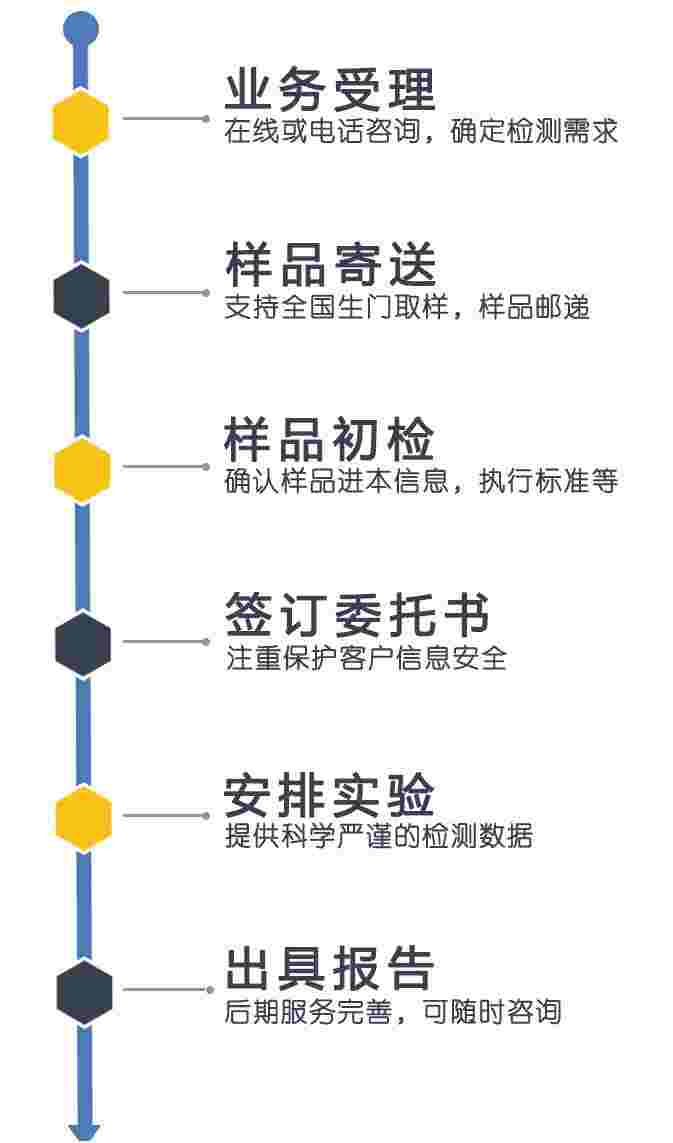
检测流程
检测优势
1、单位面向科研院所、学校和社会企业及科研单位,面向社会公共服务。
2、实验管理中心下设检测分析中心、科研测试中心、X射线应用中心。
3、面向物理、化学化工、材料、纳米、环境、电子、能源等众多学科。
4、拥有多台精密检测仪器设备。
5、能够从事材料微观结构分析、定性和定量分析、材料性能测定、材料质量综合评定等工作。
6、提供24小时开放服务、网络化的管理。
7、具备向校内外科学研究和品质鉴定提供公正、科研测试数据能力的重要机构。
检测实验室